
Class 9 Science Chapter 3 परमाणु एवं अणु: इस अध्याय में हम जानेंगे कि पदार्थ छोटे-छोटे कणों से मिलकर बने होते हैं। इन्हीं कणों को परमाणु और अणु कहते हैं। इस पाठ में आप सीखेंगे अणुओं का निर्माण कैसे होता है और रासायनिक सूत्र किस प्रकार बनाए जाते हैं।
Class 9 Science Chapter 3 परमाणु एवं अणु हिंदी में सरल नोट्स
| पाठ्यपुस्तक | NCERT |
| कक्षा | कक्षा 9 |
| विषय | विज्ञान |
| अध्याय | अध्याय 3 |
| प्रकरण | परमाणु एवं अणु |
🌟 रासायनिक संयोजन के नियम:
किन्हीं दो या उससे अधिक पदार्थों के बीच रासायनिक अभिक्रिया कुछ सिद्धांतों पर आधारित होती है। इन सिद्धांतों को रासायनिक संयोजन के नियम कहते हैं।
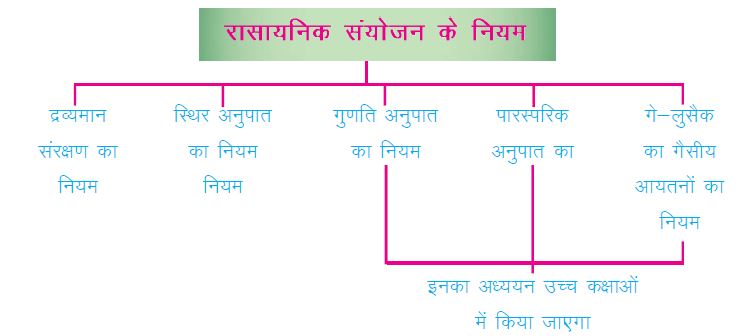
📘 द्रव्यमान संरक्षण के नियम:
▪इस नियम के अनुसार “द्रव्यमान का उदय या विनाश संभव नहीं है।”
▪किसी रासायनिक अभिक्रिया के लिए इस नियम का उपयोग निम्नलिखित तरीके से किया जा सकता है।
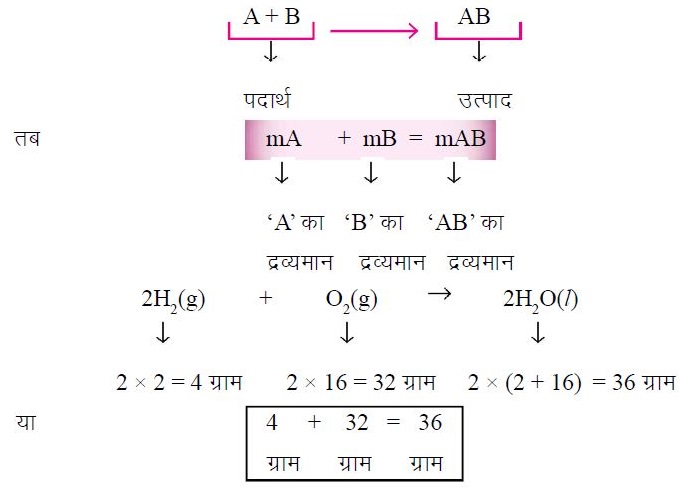
▪किसी भी रासायनिक अभिक्रिया के दौरान पदार्थों के द्रव्यमान का जोड़ उस अभिक्रिया के उत्पादों के द्रव्यमानों के जोड़ के बराबर होगा।
उदाहरण –
Class 9 Science Chapter 3 परमाणु एवं अणु के प्रश्न-उत्तरी हिन्दी में
प्रश्न – एक अभिक्रिया में 5.3 ग्राम सोडियम कार्बोनेट एवं 6.0 ग्राम एथेनोइक अम्ल अभिक्रित होते हैं। 2.2 ग्राम कार्बन-डाइऑक्साइड, 8.2 ग्राम सोडियम एथेनोएट एवं 0.9 ग्राम जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम को सिद्ध करता है।
उत्तर –

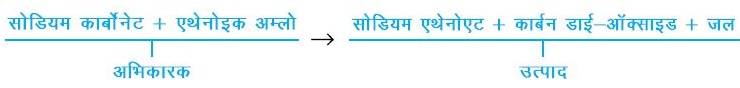
द्रव्यमान संरक्षण के नियमानुसार
सोडियम कार्बोनेट का द्रव्यमान + एथेनोइक अम्ल द्रव्यमान = सोडियम एथेनोएट का द्रव्यमान + कार्बन डाइऑक्साइड का द्रव्यमान + जल का द्रव्यमान
द्रव्यमानों को समीकरण में प्रस्तुत करने के उपरांत
5.3 ग्राम + 650 ग्राम = 8.2 ग्राम + 2.2 ग्राम + 0.9 ग्राम
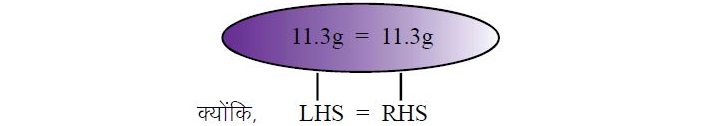
यह उत्तर द्रव्यमान संरक्षण के नियम को स्पष्ट करता है।
📘 स्थिर अनुपात का नियम:
इस नियमानुसार कोई शुद्ध रासायनिक यौगिक सदैव उन्हीं तत्वों से निर्मित होगा जिनसे वह मिलकर निर्मित हुआ है, तथा इन तत्वों के द्रव्यमान का अनुपात सदैव समान होगा, फिर चाहे यह यौगिक किसी भी स्थान से प्राप्त किया गया हो अथवा निर्माण किसी भी पद्धति द्वारा किया गया हो।
उदाहरण
18 g H2O=> 16 g ऑक्सीजन + 02 g हाइड्रोजन, या mH / mO = 2/16 = 1/8
36 g H2O => 32 g ऑक्सीजन + 04 g हाइड्रोजन, या mH / mO = 4/32 = 1/8
09 g H2O => 08 g ऑक्सीजन + 01 g हाइड्रोजन, या mH / mO = 1/8
☛ऊपर प्रस्तुत उदाहरण में H2O के अलग-अलग द्रव्यमानों वाले H2O के नमूनों को लिया गया, पर उन सब में हाइड्रोजन और ऑक्सीजन के द्रव्यमान ओं का अनुपात सदा 1:8 ही निकला।
प्रश्न – यदि हाइड्रोजन तथा ऑक्सीजन 1:8 के द्रव्यमान अनुपातानुसार अभिक्रित होकर जल का संचयन करते हैं । यदि जहां 3 ग्राम हाइड्रोजन गैस ली गई हो तब ऑक्सीजन का कितना द्रव्यमान इस हाइड्रोजन गैस से अभिक्रित हो जल का संचयन करेगा?
उत्तर –

या 24 ग्राम ऑक्सीजन गैस 3 ग्राम हाइड्रोजन गैस के अभिक्रित हो 27 ग्राम जल का संचयन करेगी ।
डाल्टन के परमाणु सिद्धांत:
रासायनिक संयोजन के नियम पर आधारित डाल्टन के परमाणु सिद्धांत, द्रव्यमान संरक्षण का नियम तथा स्थिर अनुपात के नियम को सिद्ध करता है ।
डाल्टन के परमाणु सिद्धांत के महत्वपूर्ण अंश
▪सभी द्रव्य परमाणुओं से निर्मित होते हैं।
▪परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में ना तो उत्पन्न होते हैं ना ही उनका इसमें विनाश होता है। (यह अंश द्रव्यमान संरक्षण के नियम को सिद्ध करता है)
▪दिए गए तत्व के सभी परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
▪भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न भिन्न होते हैं।
▪भिन्न भिन्न तत्वों परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में सहयोग कर यौगिक का निर्माण करते हैं। (यह अंश स्थिर अनुपात के नियम को सिद्ध करता है)
▪किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एक प्रकार निश्चित होती है।
🟠 परमाणु (Atom):
▪आधुनिक परमाणु सिद्धांत के अनुसार “परमाणु किसी भी तत्वों का वह सूक्ष्मतम भाग है जो किसी रासायनिक अभिक्रिया में बिना अपने रासायनिक एवं भौतिक गुणधर्मों को बदलें, उस अभिक्रिया में प्रयुक्त होता है।”
▪परमाणु तत्व के सूक्ष्मतम भाग है जिन्हें किसी भी शक्तिशाली सूक्ष्मदर्शी से भी देखा नहीं जा सकता।
▪सबसे सूक्ष्म हाइड्रोजन परमाणु की परमाणु त्रिज्या 0.37 x 10-10 या 0.037 nm होती है।
जहां 1 nm = 10-10 m
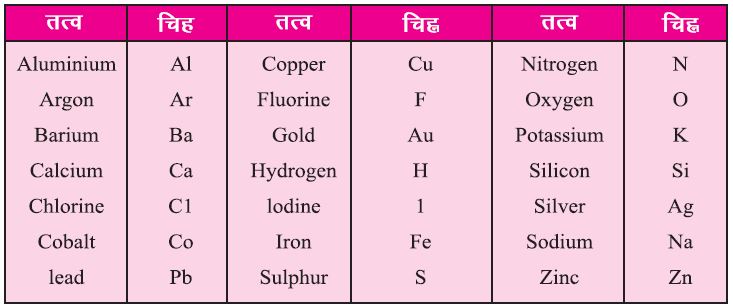
IUPAC (International Union of Pure and Applied Chemistry) द्वारा स्वीकृत तत्वों के चिन्ह –
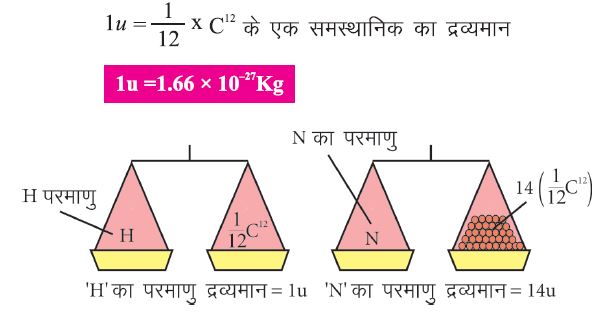
👉किसी भी तत्व के एक परमाणु का द्रव्यमान, उसका “परमाणु द्रव्यमान” कहलाता है।
👉1961 वर्ष में IUPAC ने “परमाणु द्रव्यमान की इकाई” या “u” को परमाणुओं के द्रव्यमान का मापक माना।
परमाणु द्रव्यमान की इकाई
एक परमाणु द्रव्यमान की इकाई का द्रव्यमान एक C12 समस्थानिक के 1/12 वें हिस्से के द्रव्यमान के बराबर होता है।
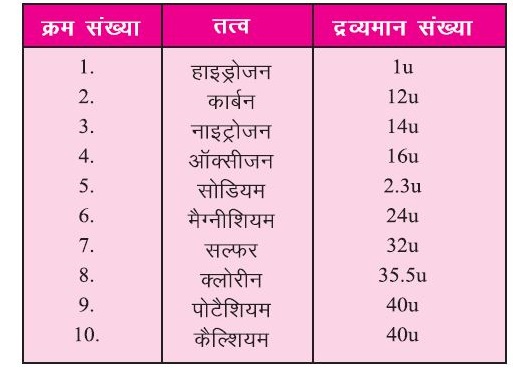
इसी तरह से –
परमाणु किस प्रकार अस्तित्व में रहते हैं?
ज्यादातर तत्वों के परमाणु अत्यधिक अभिक्रियाशील होने के कारण कभी भी मुक्त अवस्था में नहीं पाए जाते।
केवल निष्क्रिय गैसों के परमाणु ही मुक्त अवस्था में पाए जाते हैं।
उदाहरण – He, Ne, Ar, Kr, Xe, Rn
👉निष्क्रिय गैसों के परमाणुओं को छोड़ अन्य ज्यादातर तत्वों के परमाणु या तो अणुओं का निर्माण करते हैं या फिर आयन के रूप में पाए जाते है।

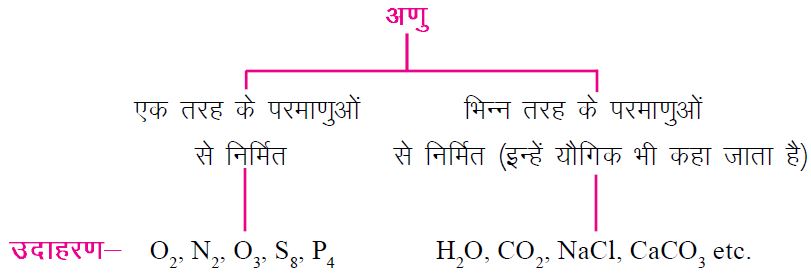
🟢 अणु (Molecule):
▪किसी अणु का निर्माण दो या उससे अधिक परमाणुओं के बीच रासायनिक बंधन उत्पन्न होने के कारण होता है।
▪अणु तत्वों को छोड़ किसी भी पदार्थ की वह सूक्ष्मतम इकाई है, जो स्वतंत्र रूप से रह सकता है और यह उस पदार्थ के सारे गुणधर्मों को प्रदर्शित कर सकता है। जैसे कि H2O अणु जल की संपूर्ण गुणधर्मों को प्रदर्शित कर सकता है।
▪किसी भी अणु का निर्माण एक ही तरह के परमाणु या भिन्न भिन्न प्रकार के परमाणुओं के बीच रासायनिक बंधन होने के कारणवश हो सकता है।
▪इसी आधार पर अणुओं को दो भागों में बांटा जा सकता है।
🌕 परमाणुकता (Atomicity):
किसी एक अन्य उपस्थित परमाणुओं की संख्या को परमाणुकता कहते हैं।
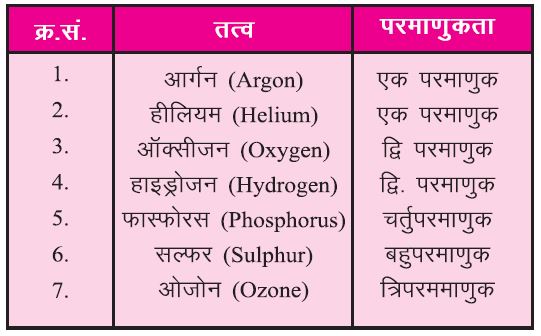
नोट-निष्क्रिय गैसें एक परमाणुक अणुओं का निर्माण करती है।
🧪 रासायनिक सूत्र (Chemical Formula):
रासायनिक सूत्र किसी पदार्थ में उपस्थित तत्वों के प्रकार और संख्या को दर्शाने वाला प्रतीकात्मक (symbolic) रूप होता है।
यह हमें यह बताता है कि उस यौगिक में कौन-कौन से तत्व हैं और कितनी संख्या में हैं।
कुछ सामान्य रासायनिक सूत्र और उनके अर्थ:
| रासायनिक सूत्र | नाम | अर्थ |
|---|---|---|
| H₂O | जल | 2 हाइड्रोजन + 1 ऑक्सीजन |
| CO₂ | कार्बन डाइऑक्साइड | 1 कार्बन + 2 ऑक्सीजन |
| NaCl | सोडियम क्लोराइड (नमक) | 1 सोडियम + 1 क्लोरीन |
| CH₄ | मीथेन | 1 कार्बन + 4 हाइड्रोजन |
| CaCO₃ | कैल्शियम कार्बोनेट | 1 कैल्शियम + 1 कार्बन + 3 ऑक्सीजन |
| NH₃ | अमोनिया | 1 नाइट्रोजन + 3 हाइड्रोजन |
🔬 रासायनिक सूत्र की विशेषताएं:
1. तत्वों की जानकारी देता है
रासायनिक सूत्र यह बताता है कि किसी यौगिक में कौन-कौन से तत्व उपस्थित हैं।
उदाहरण:
👉 H₂O में तत्व हैं – हाइड्रोजन (H) और ऑक्सीजन (O)।
2. प्रत्येक तत्व की संख्या दर्शाता है
सूत्र में दिए गए अंकों (subscripts) से यह पता चलता है कि हर तत्व की कितनी संख्या है।
उदाहरण:
👉 H₂O में 2 हाइड्रोजन और 1 ऑक्सीजन।
3. संयोजन का अनुपात बताता है
यह हमें विभिन्न तत्वों के आपसी अनुपात की जानकारी देता है।
उदाहरण:
👉 NaCl में Na : Cl = 1 : 1
👉 CaCl₂ में Ca : Cl = 1 : 2
4. किसी पदार्थ की संरचना का संक्षिप्त रूप है
यह पूरे यौगिक की संरचना को संक्षेप में दिखाता है – जिसे देखकर वैज्ञानिक या छात्र उसके गुण और व्यवहार का अनुमान लगा सकते हैं।
5. अभिक्रिया में भाग लेने वाले तत्वों की पहचान करता है
रासायनिक सूत्र यह बताता है कि किस तत्व के कितने अणु रासायनिक अभिक्रिया में भाग लेंगे।
6. परमाणविक और आणविक द्रव्यमान निकालने में मदद करता है
सूत्र को देखकर ही हम किसी यौगिक का आणविक द्रव्यमान या मोल द्रव्यमान निकाल सकते हैं।
7. लैटिन या अंग्रेज़ी प्रतीकों का उपयोग होता है
रासायनिक सूत्र में तत्वों को दर्शाने के लिए उनके प्रतीक चिन्ह (symbols) का प्रयोग किया जाता है, जैसे –
H = Hydrogen, O = Oxygen, Na = Sodium, Cl = Chlorine
🔹 आणविक द्रव्यमान (Molecular Mass):
अणु या आणविक द्रव्यमान किसी अणु में मौजूद सभी परमाणुओं के परमाणु द्रव्यमानों का कुल योग होता है।
आसान भाषा में:
किसी अणु में जितने परमाणु होते हैं, उन सभी का परमाणु द्रव्यमान जोड़ने पर जो मान प्राप्त होता है, वही आणविक द्रव्यमान कहलाता है।
▪इसे amu (atomic mass unit) या u में मापा जाता है।
उदाहरण (Examples):
| अणु | संरचना | परमाणु द्रव्यमान (amu) | आणविक द्रव्यमान (amu) |
|---|---|---|---|
| H₂ | H = 1 | 1 × 2 = 2 | 2 amu |
| H₂O | H = 1, O = 16 | (2×1) + 16 = 18 | 18 amu |
| CO₂ | C = 12, O = 16 | 12 + (2×16) = 44 | 44 amu |
| NH₃ | N = 14, H = 1 | 14 + (3×1) = 17 | 17 amu |
| CH₄ | C = 12, H = 1 | 12 + (4×1) = 16 | 16 amu |
🔹 सूत्र इकाई द्रव्यमान:
▪सूत्र इकाई द्रव्यमान उस आयनिक यौगिक (ionic compound) की सबसे छोटी इकाई (formula unit) का कुल द्रव्यमान होता है।
किसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमानों का योग होता है, जिसे amu (atomic mass unit) में मापा जाता है।
यह अणु द्रव्यमान जैसा होता है, लेकिन उन यौगिकों के लिए प्रयोग होता है जो अणु नहीं बनाते, बल्कि क्रिस्टलीय ठोस रूप में होते हैं, जैसे NaCl, KNO₃, CaCl₂ आदि।
उदाहरण –
NaCl (सोडियम क्लोराइड):
- Na = 23 amu
- Cl = 35.5 amu
👉 सूत्र इकाई द्रव्यमान = 23 + 35.5 = 58.5 amu
CaCl₂ (कैल्शियम क्लोराइड):
- Ca = 40 amu
- Cl = 35.5 × 2 = 71 amu
👉 सूत्र इकाई द्रव्यमान = 40 + 71 = 111 amu
🔢 रासायनिक सूत्र निर्माण के लिए आवश्यक नियम:
1. संयोजकता या आयन आवेश संतुलित होना चाहिए
- किसी रासायनिक यौगिक का सूत्र बनाते समय, धनात्मक और ऋणात्मक आयनों के आवेश बराबर होने चाहिए।
- संयोजकता (Valency) के आधार पर क्रॉस विधि से संख्या निर्धारित की जाती है।
उदाहरण:
- Na⁺ (1) + Cl⁻ (1) → NaCl
- Ca²⁺ (2) + O²⁻ (2) → CaO
2. धातु पहले, अधातु बाद में लिखा जाता है
- रासायनिक सूत्र में धातु (metal) पहले और अधातु (non-metal) बाद में आता है।
उदाहरण:
- CaO (कैल्शियम ऑक्साइड)
- NaCl (सोडियम क्लोराइड)
- CuO (कॉपर ऑक्साइड)
3. बहुपरमाण्विक आयन को ब्रैकेट में रखा जाता है (यदि वह दो या अधिक बार आता है)
- जब किसी बहुपरमाण्विक आयन (Polyatomic Ion) का उपयोग दो या अधिक बार करना हो, तो उसे ब्रैकेट () में रखकर नीचे संयोजकता लगाते हैं।
उदाहरण:
- Ca²⁺ + OH⁻ → Ca(OH)₂
- NH₄⁺ + SO₄²⁻ → (NH₄)₂SO₄
4. संयोजकता के अनुसार क्रॉस विधि अपनाएं (Criss-Cross Method)
- दो तत्वों की संयोजकताएँ आपस में क्रॉस करके लिखें।
उदाहरण:
| तत्व A | संयोजकता | तत्व B | संयोजकता | सूत्र |
|---|---|---|---|---|
| Al | 3 | O | 2 | Al₂O₃ |
| Ca | 2 | Cl | 1 | CaCl₂ |
| Al | 3 | SO₄ | 2 | Al₂(SO₄)₃ |
कुछ अन्य उदाहरण:

🔢 आयन (Ion):
आयन, एक परमाणु या परमाणुओं का समूह होता है जिस पर कुछ आवेश (धनात्मक या ऋणात्मक) अवश्य उपस्थित रहता है।
धनावेशित आयन – Na+, K+, Ca2+, Al3+
ऋणावेशित आयन – Cl–, S2-, OH–, SO42-
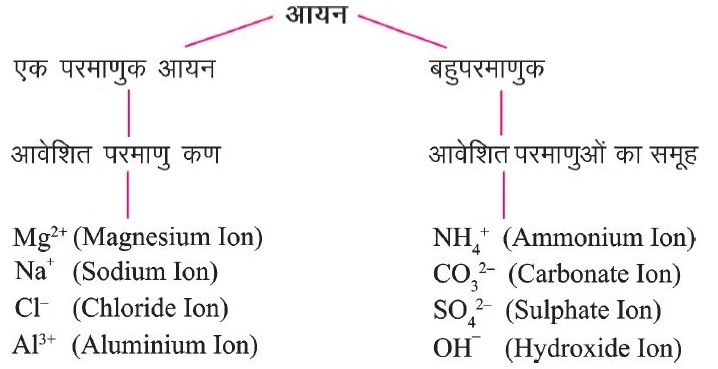
आयनिक यौगिकों के रासायनिक सूत्र (यौगिक आयन)

⚖️ मोल द्रव्यमान (Molar Mass):
मोल द्रव्यमान किसी पदार्थ के 1 मोल (6.022 × 10²³ कण) का कुल द्रव्यमान होता है।
अर्थात,
1 मोल अणुओं, परमाणुओं या आयनों का जितना भार ग्राम में होता है, वही उसका मोल द्रव्यमान कहलाता है।
▪इसे ग्राम प्रति मोल (g/mol) में मापा जाता है।
उदाहरण (Examples):
| पदार्थ | परमाणु/अणु | परमाणु द्रव्यमान | मोल द्रव्यमान (g/mol) |
|---|---|---|---|
| H (हाइड्रोजन) | 1 H | 1 amu | 1 g/mol |
| O₂ (ऑक्सीजन गैस) | 2 O | 16 × 2 = 32 amu | 32 g/mol |
| H₂O (पानी) | 2 H + 1 O | (2×1) + 16 = 18 amu | 18 g/mol |
| CO₂ (कार्बन डाइऑक्साइड) | 1 C + 2 O | 12 + (2×16) = 44 amu | 44 g/mol |
| NaCl (नमक) | Na + Cl | 23 + 35.5 = 58.5 amu | 58.5 g/mol |
🔄 मोल संकल्पना (Mole Concept):
मोल (Mole) किसी भी पदार्थ की मात्रा का एक मापक है, जिसमें 6.022 × 10²³ कण (Atoms, Molecules, Ions आदि) होते हैं। इस संख्या को एवोगैड्रो संख्या (Avogadro’s Number) कहा जाता है।
👉 1 मोल = 6.022 × 10²³ कण
उदाहरण (Examples):
NaCl (सोडियम क्लोराइड) का मोल द्रव्यमान
= 23 + 35.5 = 58.5 g/mol
👉 यानी 58.5 ग्राम NaCl में 1 मोल अणु होंगे।
1 मोल H₂O (पानी) में
= 6.022 × 10²³ अणु होते हैं
= इसमें 2 × 6.022 × 10²³ हाइड्रोजन परमाणु
1 × 6.022 × 10²³ ऑक्सीजन परमाणु
1 मोल CO₂ गैस का आयतन (STP पर)
= 22.4 लीटर
